Preparazione dell'Olio di Oliva alla Cannabis
- Carlo Therapy
- Dicembre, 14, 2024
- Tik tok
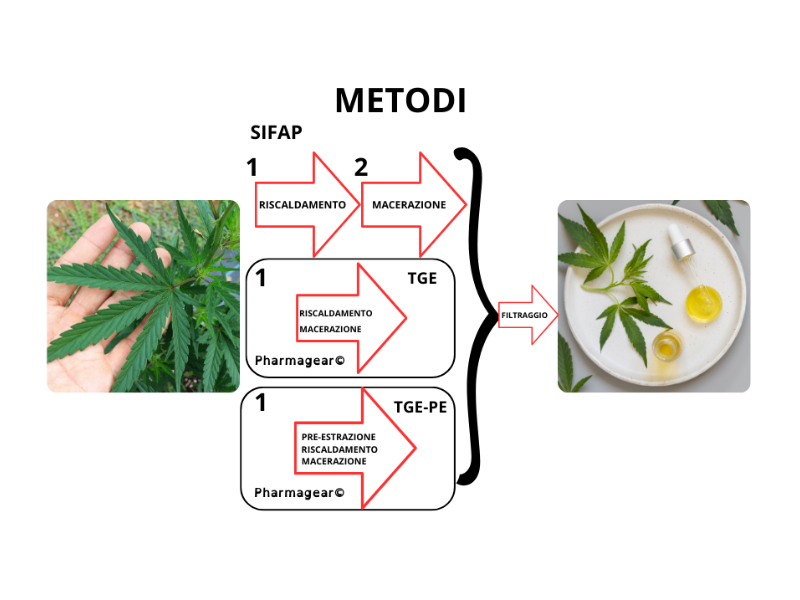
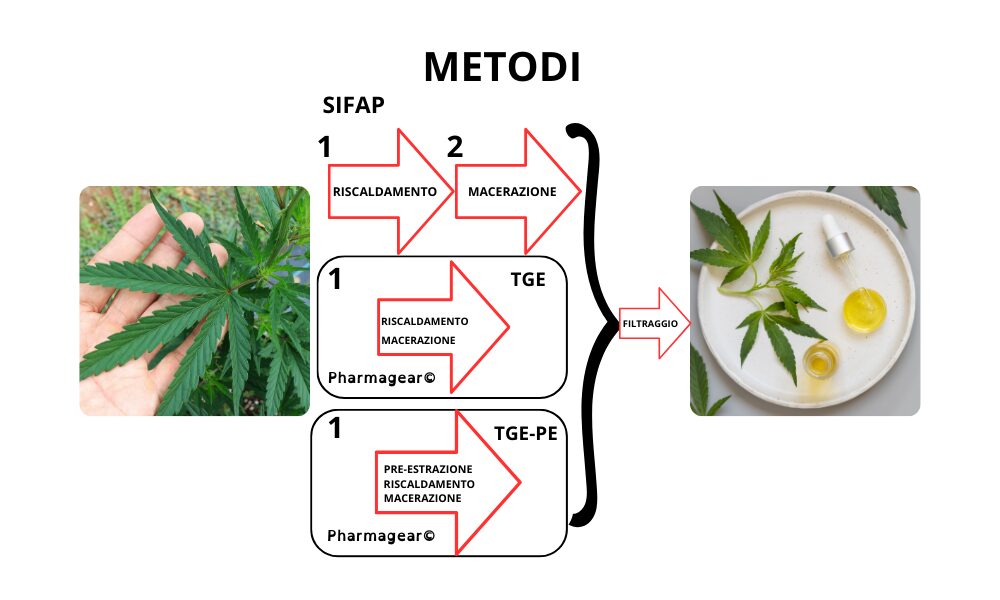
I 3 Metodi di Preparazione dell’olio d’oliva alla cannabis:
Tecnologie digitali applicate al controllo del processo in un unico passaggio di preparazione dell’olio di oliva alla cannabis.
Estratto Studio: Olio d’Oliva alla Cannabis
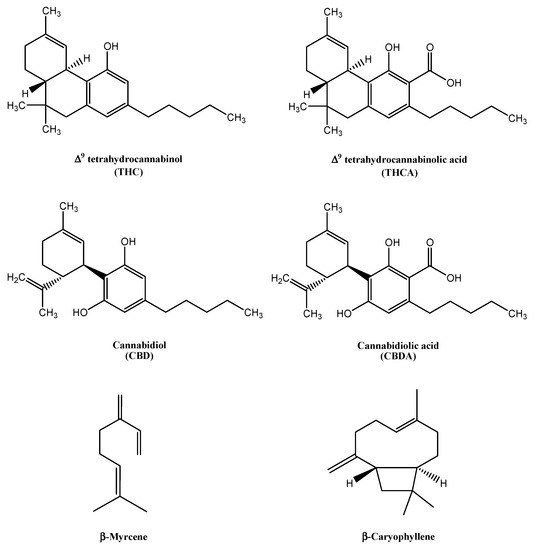
Cannabis sativa L .; formulazione di olio d’oliva ; estrazione ; decarbossilazione ; cannabinoidi ; terpeni
Introduzione
2. Materiali e metodi per preparare l’olio d’oliva alla cannabis
2.1. Chimico e solvente
2.2. Apparecchiature e strumenti Pharmagear ®
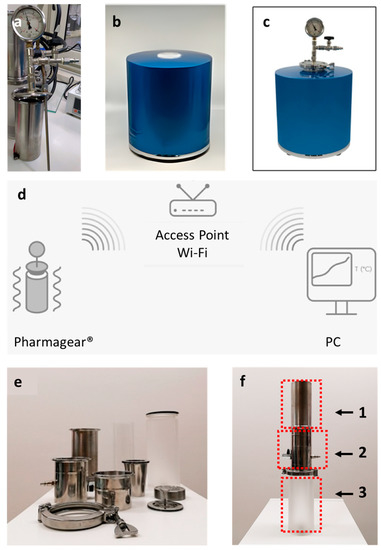
2.3. Preparazione degli Estratti di Cannabis in Olio di Oliva
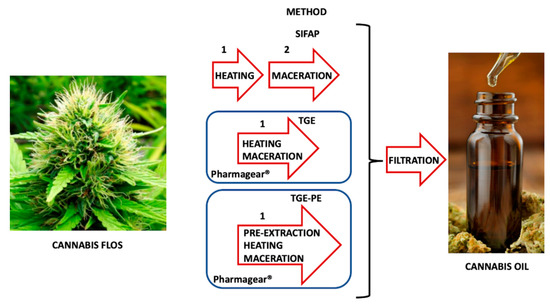
2.4. Estratto di Cannabis in Olio di Oliva con la Procedura SIFAP (Processo di Macerazione)
2.5. Strumento e metodo HPLC
Curva di calibrazione
2.6. Preparazione dei campioni e analisi di cannabinoidi e terpeni
2.7. Analisi statistica
3. Risultati e discussioni
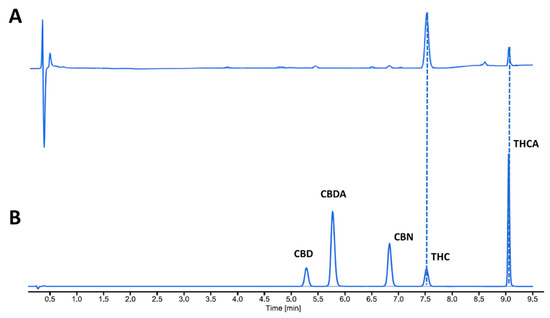
4. Conclusioni
5. Brevetto
Contributi dell’autore
Finanziamento
Dichiarazione del comitato di revisione istituzionale
Dichiarazione di consenso informato
Dichiarazione sulla disponibilità dei dati
Ringraziamenti
Conflitto di interessi
Riferimenti
- Hartsel, JA; Eades, J.; Hickory, B.; Makriyannis, A. Cannabis Sativa e canapa, Cannabis Sativa e canapa ; Gupta, RC, Ed.; Nutraceutici: Efficacia, Sicurezza e Tossicità; Elsevier Inc.: Londra, Regno Unito, 2016; pagine 735–754. [ Google Scholar ]
- Ternelli, M.; Brighenti, V.; Anceschi, L.; Poto, M.; Bertelli, D.; Licata, M.; Pellati, F. Metodi innovativi per la preparazione di oli di Cannabis terapeutici ad alto contenuto sia di cannabinoidi che di terpeni. J. Pharm. Biomed. Anal. 2020 , 186 , 113296. [ Google Scholar ] [ CrossRef ]
- Andre, CM; Hausman, JF; Guerriero, G. Cannabis sativa: la pianta dalle mille e una molecola. Front. Plant Sci. 2016 , 7 , 1–17. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ Green Version ]
- Appendino, G.; Chianese, G.; Taglialatela-Scafati, O. Cannabinoidi: presenza e chimica medicinale. Corrente Med. Chimica 2011 , 18 , 1085–1099. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Tommaso, fidanzato; ElSohly, MA La chimica analitica della cannabis: valutazione della qualità, garanzia e regolamentazione della marijuana medicinale e dei preparati a base di cannabinoidi , 1a ed.; Elsevier: Amsterdam, Paesi Bassi; Oxford, Regno Unito; Waltham, MA, Stati Uniti, 2015. [ Google Scholar ]
- Protti, M.; Brighenti, V.; Battaglia, MR; Anceschi, L.; Pellati, F.; Mercolini, L. Cannabinoidi da Cannabis sativa L.: un nuovo strumento basato su HPLC-DAD-MS/MS per un uso razionale in chimica medicinale. ACS Med. Chem. Lett. 2019 , 10 , 539–544. [ Google Scholar ] [ CrossRef ]
- Pellati, F.; Brighenti, V.; Sperlea, J.; Marchetti, L.; Bertelli, D.; Benvenuti, S. Nuovi metodi per l’analisi completa dei composti bioattivi nella Cannabis sativa L. (canapa). Molecole 2018 , 23 , 2639. [ Google Scholar ] [ CrossRef ] [ Versione verde ]
- Brighenti, V.; Pellati, F.; Steinbach, M.; Maran, D.; Benvenuti, S. Sviluppo di una nuova tecnica di estrazione e metodo HPLC per l’analisi dei cannabinoidi non psicoattivi nella Cannabis sativa L. di tipo fibra (canapa). J. Pharm. Biomedico. Anale. 2017 , 143 , 228–236. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Pellati, F.; Borgonetti, V.; Brighenti, V.; Biagi, M.; Benvenuti, S.; Corsi, L. Cannabis sativa L. e cannabinoidi non psicoattivi: la loro chimica e ruolo contro lo stress ossidativo, l’infiammazione e il cancro. Biomedico. Ris. interno 2018 , 2018 , 1691428. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ Versione Verde ]
- Iseppi, r.; Brighenti, V.; Licata, M.; Lambertini, A.; Sabia, C.; Messi, P.; Pellati, F.; Benvenuti, S. Caratterizzazione chimica e valutazione dell’attività antibatterica degli oli essenziali di tipo fibra di Cannabis sativa L. (Canapa). Molecules 2019 , 24 , 2302. [ Google Scholar ] [ CrossRef ] [ Green Version ]
- Mechoulam, R.; Hanuš, LO; Pertwee, R.; Howlett, AC Dalla chimica dei fitocannabinoidi agli endocannabinoidi e oltre. Nat. Rev. Neurosci. 2014 , 15 , 757–764. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Corsi, L.; Pellati, F.; Brighenti, V.; Plessi, N.; Benvenuti, S. Composizione chimica e attività neuroprotettiva in vitro della Cannabis sativa L. di tipo fibra (canapa). Curr. Bioatto. Comp. 2019 , 15 , 201–210. [ Google Scholar ] [ CrossRef ]
- Russo, E.; Guy, GW Una storia di due cannabinoidi: la logica terapeutica per combinare tetraidrocannabinolo e cannabidiolo. Med. Ipotesi 2006 , 66 , 234–246. [ Google Scholar ] [ CrossRef ]
- La FDA approva la marijuana liquida per i malati di AIDS e di cancro. Disponibile online: https://hightimes.com/news/fda-approves-liquid-marijuana-for-aids-and-cancer-patients/ (accesso il 28 luglio 2016).
- Casiraghi, A.; Roda, G.; Casagni, E.; Cristina, C.; Musazzi, UM; Franzè, S.; Rocco, P.; Giuliani, C.; Fico, G.; Minghetti, P.; et al. Metodo di estrazione e analisi dei cannabinoidi nelle preparazioni di olio d’oliva alla cannabis. Pianta Med. 2018 , 84 , 242–249. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ Versione verde ]
- Russo, EB; Marcu, J. Farmacologia della cannabis: i soliti sospetti e alcune piste promettenti. Adv. Pharmacol. 2017 , 80 , 67–134. [ Google Scholar ]
- Russo, EB Domare il THC: potenziale sinergia della cannabis ed effetti dell’entourage di fitocannabinoidi-terpenoidi. Fratello J. Pharmacol. 2011 , 163 , 1344–1364. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Navari, RM Gestione della nausea e del vomito indotti dalla chemioterapia: attenzione ai nuovi agenti e ai nuovi usi per gli agenti più vecchi. Drugs 2013 , 73 , 249–262. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Finnerup, NB; Attal, N.; Harutounian, S.; Mcnicol, E.; Barone, R.; Dworkin, RH; Gilron, L.; Haanpää, M.; Hansson, P.; Jensen, Texas; et al. Farmacoterapia per il dolore neuropatico negli adulti: una revisione sistematica e una meta-analisi. Lancetta Neurol. 2015 , 14 , 162–173. [ Google Scholar ] [ CrossRef ] [ Versione verde ]
- Leussink, VI; Husseini, L.; Warnke, C.; Broussalis, E.; Hartung, HP; Kieseier, BC Terapia sintomatica nella sclerosi multipla: il ruolo dei cannabinoidi nel trattamento della spasticità. Avv. Neurolo. Disordine. 2012 , 5 , 255–266. [ Google Scholar ] [ CrossRef ] [ Versione verde ]
- Haney, M.; Gunderson, EW; Rabkin, J.; Hart, CL; Vosburg, SK; Comer, SD; Foltin, RW Dronabinol e marijuana nei fumatori di marijuana HIV-positivi. Assunzione calorica, umore e sonno. J. Acquir. Immune Defic. Syndr. 2007 , 5 , 545–554. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ Versione verde ]
- Ramella, A.; Roda, G.; Pavlovic, R.; Cas, MD; Casagni, E.; Mosconi, G.; Cecati, F.; Minghetti, P.; Grizzetti, C. Impatto delle fonti lipidiche sulle caratteristiche qualitative delle preparazioni di olio a base di cannabis medica. Molecules 2020 , 25 , 2986. [ Google Scholar ] [ CrossRef ]
- Palmieri, B.; Laurino, C.; Vadalà, M. Studio spontaneo, aneddotico, retrospettivo, in aperto sull’efficacia, sicurezza e tollerabilità di preparati galenici di Cannabis (Bedrocan). Int. J. Pharm. Pract. 2019 , 27 , 264–270. [ Google Scholar ] [ CrossRef ] [ Green Version ]
- Calvi, L.; Pavlovic, R.; Panseri, S.; Giupponi, L.; Leoni, V.; Giorgi, A. Tratti di qualità della cannabis medica sativa L. Infiorescenze e prodotti derivati basati su un’indagine analitica completa di spettrometria di massa. Nei recenti progressi nella ricerca sui cannabinoidi ; Costain, W., Laprairie, R., a cura di; IntechOpen: Londra, Regno Unito, 2018; Disponibile online: https://www.intechopen.com/chapters/63068 (accesso il 5 novembre 2018).
- Pavlovic, R.; Nenna, G.; Calvi, L.; Panseri, S.; Borgonovo, G.; Giupponi, L.; Cannazza, G.; Giorgi, A. Caratteristiche qualitative degli “oli di cannabidiolo”: contenuto di cannabinoidi, impronta terpenica e stabilità all’ossidazione di preparazioni europee disponibili in commercio. Molecules 2018 , 23 , 1230. [ Google Scholar ] [ CrossRef ] [ Green Version ]
- Decreto 9 Novembre 2015: Funzioni di Organismo Statale per la Cannabis Previsto Dagli Articoli 23 e 28 Della Convenzione Unica Sugli Stupefacenti del 1961, Come Modificata nel 1972. Disponibile online: http://www.gazzettaufficiale.it/eli/id/2015/ 30/11/15A08888/sg;jsessionid=p1rnwNujUKlqQ5azhA%20Q95A__.ntc-as3-guri2a (accesso il 1 maggio 2020).
- Carcieri, C.; Tomasello, C.; Simiele, M.; De Nicolò, A.; Avataneo, V.; Canzoneri, L.; Cusato, J.; Di Perri, G.; D’Avolio, A. Variabilità della concentrazione di cannabinoidi nelle preparazioni galeniche di olio d’oliva di cannabis. J. Pharm. Farmaco. 2018 , 70 , 143–149. [ Google Scholar ] [ CrossRef ]
- Pacifici, R.; Marchei, E.; Salvatore, F.; Guandalini, L.; Busardò, FP; Pichini, S. Valutazione della concentrazione e della stabilità dei cannabinoidi nelle preparazioni standardizzate di tè alla cannabis e olio di cannabis mediante cromatografia liquida ad altissime prestazioni e spettrometria di massa tandem. Clinica. Chimica. Laboratorio. Med. 2017 , 55 , 1555–1563. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Pacifici, R.; Marchei, E.; Salvatore, F.; Guandalini, L.; Busardò, FP; Pichini, S. Valutazione della stabilità a lungo termine dei cannabinoidi in preparazioni standardizzate di cime fiorite di cannabis e olio di cannabis mediante cromatografia liquida ad altissime prestazioni e spettrometria di massa tandem. Clinica. Chimica. Laboratorio. Med. 2018 , 28 , 94–96. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Citti, C.; Ciccarella, G.; Braghiroli, D.; Parenti, C.; Vandelli, MA; Cannazza, G. Cannabis medicinale: Concentrazione dei principali cannabinoidi e loro stabilità valutate mediante cromatografia liquida ad alte prestazioni accoppiata a spettrometria di massa a tempo di volo a diodi e quadrupoli. J. Pharm. Biomed. Anal. 2016 , 128 , 201–209. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Calvi, L.; Pentimalli, D.; Panseri, S.; Giupponi, L.; Gelmini, F.; Beretta, G.; Vitali, D.; Bruno, M.; Zilio, E.; Pavlovic, R.; et al. Valutazione completa della qualità delle infiorescenze e degli oli macerati di Cannabis sativa L. medica basata su HS-SPME accoppiato all’approccio GC–MS e LC-HRMS (q-exactive orbitrap ® ). J. Pharm. Biomedico. Anale. 2018 , 150 , 208–219. [ Google Scholar ] [ CrossRef ]
- Romano, L.; Hazekamp, A. Una panoramica dei metodi di preparazione galenica per la cannabis medicinale. Curr. Bioatto. Comp. 2019 , 15 , 174–195. [ Google Scholar ] [ CrossRef ]
- Romano, L.; Hazekamp, A. Olio di cannabis: valutazione chimica di un futuro medicinale a base di cannabis. Cannabinoidi 2013 , 1 , 1–11. [ Google Scholar ]
- Estratto Oleoso di Infiorescenze Femminili di Cannabis. Disponibile online: https://www.sifap.org/procedure/estrazione-oleosa-di-infiorescenze-femminili-di-cannabi (ultimo accesso 19 settembre 2021).
- Storm, C.; Zumwalt, M.; Macherone, A. Agilent Note Cannabis and Hemp Testing. Dedicated Cannabinoid Potency Testing in Cannabis or Hemp Products Using the Agilent 1220 Infinity II LC System. Disponibile online: https://www.agilent.com/cs/library/applications/application-dedicated-cannabinoid-potency-testing-5991-9285-en-us-agilent.pdf (consultato il 22 maggio 2020).
- Aiello, A.; Pizzolongo, F.; Scognamiglio, G.; Romano, A.; Masi, P.; Romano, R. Effetti dell’estrazione di anidride carbonica supercritica e liquida sull’olio di semi di canapa ( Cannabis sativa L.). interno J.Scienze Alimentari. Tecnologia. 2020 , 55 , 2472–2480. [ Google Scholar ] [ CrossRef ]
- Weston-Green, K.; Clunas, H.; Jimenez Naranjo, C. Una revisione del potenziale utilizzo di pinene e linalolo come medicinali a base di terpeni per la salute del cervello: scoperta di nuove terapie nei sapori e nelle fragranze della cannabis. Davanti. Psichiatria 2021 , 12 , 583211. [ Google Scholar ] [ CrossRef ]
- Pamplona, FA; da Silva, LR; Coan, AC Potenziali benefici clinici degli estratti ricchi di CBD rispetto al CBD purificato nell’epilessia resistente al trattamento: meta-analisi dei dati osservazionali. Davanti. Neurolo. 2018 , 9 , 759. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ Versione verde ]
- Bibrey, JA; Ortiz, YT; Felice, JS; McMahon, LR; Wilkerson, JL Valutazione dei terpeni-cariofillene, -terpineolo e -terpinene nel modello di lesione cronica da costrizione del topo del dolore neuropatico: possibile coinvolgimento dei recettori dei cannabinoidi. Psicofarmacologia 2021 , 239 , 1475–1486. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Yoshida, N.; Takada, T.; Yamamura, Y.; Adachi, I.; Suzuki, H.; Kawakami, J. Effetti inibitori dei terpenoidi sulla proteina 2 associata alla resistenza multifarmaco e sul trasporto mediato da proteine della resistenza al cancro al seno. Metab. dei farmaci Dispos. 2008 , 36 , 1206–1211. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ Versione verde ]
- Schmitt, S.; Schaefer, UF; Doebler, L.; Reichling, J. Interazione cooperativa di monoterpeni e fenilpropanoidi sulla permeazione della pelle umana in vitro di oli essenziali composti complessi. Pianta Med. 2009 , 75 , 1381–1385. [ Google Scholar ] [ CrossRef ]
- Yamane, MA; Williams, AC; Barry, BW Potenziatori della penetrazione dei terpeni nei sistemi co-solventi glicole propilenico/acqua: efficacia e meccanismo d’azione. J. Pharm. Pharmacol. 1995 , 47 , 978–989. [ Google Scholar ] [ CrossRef ]
- Şenyiğit, T.; Padula, C.; Özer, Ö.; Santi, P. Diversi approcci per migliorare l’accumulo cutaneo di corticosteroidi topici. interno J. Pharm. 2009 , 380 , 155–160. [ Google Scholar ] [ CrossRef ]
- Furuishi, T.; Kato, Y.; Fukami, T.; Suzuki, T.; Endo, T.; Nagase, H.; Ueda, H.; Tomono, K. Effetto dei terpeni sulla permeazione cutanea del dicloridrato di lomerizina. J. Pharm. Farm. Sci. 2013 , 16 , 551–563. [ Google Scholar ] [ CrossRef ] [ Versione verde ]
- Femenía-Font, A.; Balaguer-Fernández, C.; Merino, V.; Rodilla, V.; López-Castellano, A. Effetto dei potenziatori chimici sull’assorbimento percutaneo in vitro del sumatriptan succinato. Euro. J. Pharm. Biofarmaceutica. 2005 , 61 , 50–55. [ Google Scholar ] [ CrossRef ]
- Guo, X.; Rong, Y.; Zhang, L.; Sì, JC potenzia l’effetto del potenziatore chirale linalolo sulla permeazione cutanea del naprossene. Acta Acad. Med. Peccato. 2016 , 38 , 55–61. [ Google Scholar ]
- Sexton, M.; Shelton, K.; Haley, P.; West, M. Valutazione del contenuto di cannabinoidi e terpenoidi: fiore di cannabis rispetto al concentrato di CO 2 supercritico . Pianta Med. 2018 , 84 , 234–241. [ Google Scholar ] [ CrossRef ] [ Versione verde ]
- Pang, MH; Kim, Y.; Jung, KW; Cho, S.; Lee, DH Una serie di casi di studio: metodologia pratica per l’identificazione di farmaci multi-target antinocicettivi. Scoperta della droga 2012 , 17 , 425–434. [ Google Scholar ] [ CrossRef ] [ PubMed ]
Disclaimer/Nota dell’editore: le dichiarazioni, le opinioni e i dati contenuti in tutte le pubblicazioni appartengono esclusivamente ai singoli autori e collaboratori e non a MDPI e/o al/ai redattore/i. MDPI e/o il/i redattore/i declinano ogni responsabilità per eventuali danni a persone o proprietà derivanti da idee, metodi, istruzioni o prodotti a cui si fa riferimento nel contenuto. |
Bongiorno, P.; Lopalco, A.; Casiraghi, A.; Spennacchio, A.; Pitruzzella, A.; Lopedota, AA; Minghetti, P.; Denora, N. Tecnologie digitali applicate al controllo del processo in un unico passaggio di preparazioni di olio di oliva di cannabis. Pharmaceutics 2023 , 15 , 870. https://doi.org/10.3390/pharmaceutics15030870
Stile AMA
Bongiorno P, Lopalco A, Casiraghi A, Spennacchio A, Pitruzzella A, Lopedota AA, Minghetti P, Denora N. Tecnologie digitali applicate al controllo del processo in un unico passaggio di preparazioni di olio di oliva di cannabis. Farmaceutica . 2023; 15(3):870. https://doi.org/10.3390/pharmaceutics15030870
Stile Chicago/Turabian
Bongiorno, Paolo, Antonio Lopalco, Antonella Casiraghi, Antonio Spennacchio, Alessandro Pitruzzella, Angela Assunta Lopedota, Paola Minghetti, and Nunzio Denora. 2023. “Tecnologie digitali applicate al controllo del processo in una sola fase delle preparazioni di olio d’oliva alla cannabis” Farmaceutica 15, n. 3: 870. https://doi.org/10.3390/pharmaceutics15030870
Gli Autori:
Di Paolo Bongiorno, Antonio Lopalco, Antonella Casiraghi, Antonio Spennacchio, Alessandro Pitruzzella, Angela Assunta Lopedota, Paola Minghetti e Nunzio Denora.
Disclaimer Carlo Therapy
Ipermobilità miglioramenti duraturi con cannabis
Cannabis terapeutica: benefici duraturi per i pazienti…
NEWSLETTER
Iscriviti per rimanere aggiornato sulle ultime novità nel mondo della cannabis terapeutica.
Cannabis Medica e ADHD Home » Blog La Cannabis Medica come Rimedio per gli Effetti dell’ADHD Carlo Therapy Dicembre, 14, 2024 facebook Tik tok Instagram…
Cannabis e Dolore da Arto Fantasma Home » Blog Come Alleviare il Dolore da “Arto Fantasma” con i Cannabinoidi Carlo Therapy Dicembre, 14, 2024 facebook…
Olio di CBD: Proprietà e Benefici Home » Blog L’Olio di CBD: Cos’è e Perchè fa Bene Carlo Therapy Dicembre, 14, 2024 facebook Tik tok…
Trattamento con Cannabinoidi per la Fibromialgia Home » Blog Cannabis e Fibromialgia Carlo Therapy Dicembre, 14, 2024 facebook Tik tok Instagram La Domanda di un…
Controllo Digitale per Olio di Oliva alla Cannabis Home » Blog Preparazione dell’Olio di Oliva alla Cannabis Carlo Therapy Dicembre, 14, 2024 facebook Tik tok…
I Derivati della Cannabis Home » Blog Cannabis: I Derivati Carlo Therapy Dicembre, 14, 2024 facebook Tik tok Instagram Derivati della Cannabis: Salute, Benessere e Bellezza…